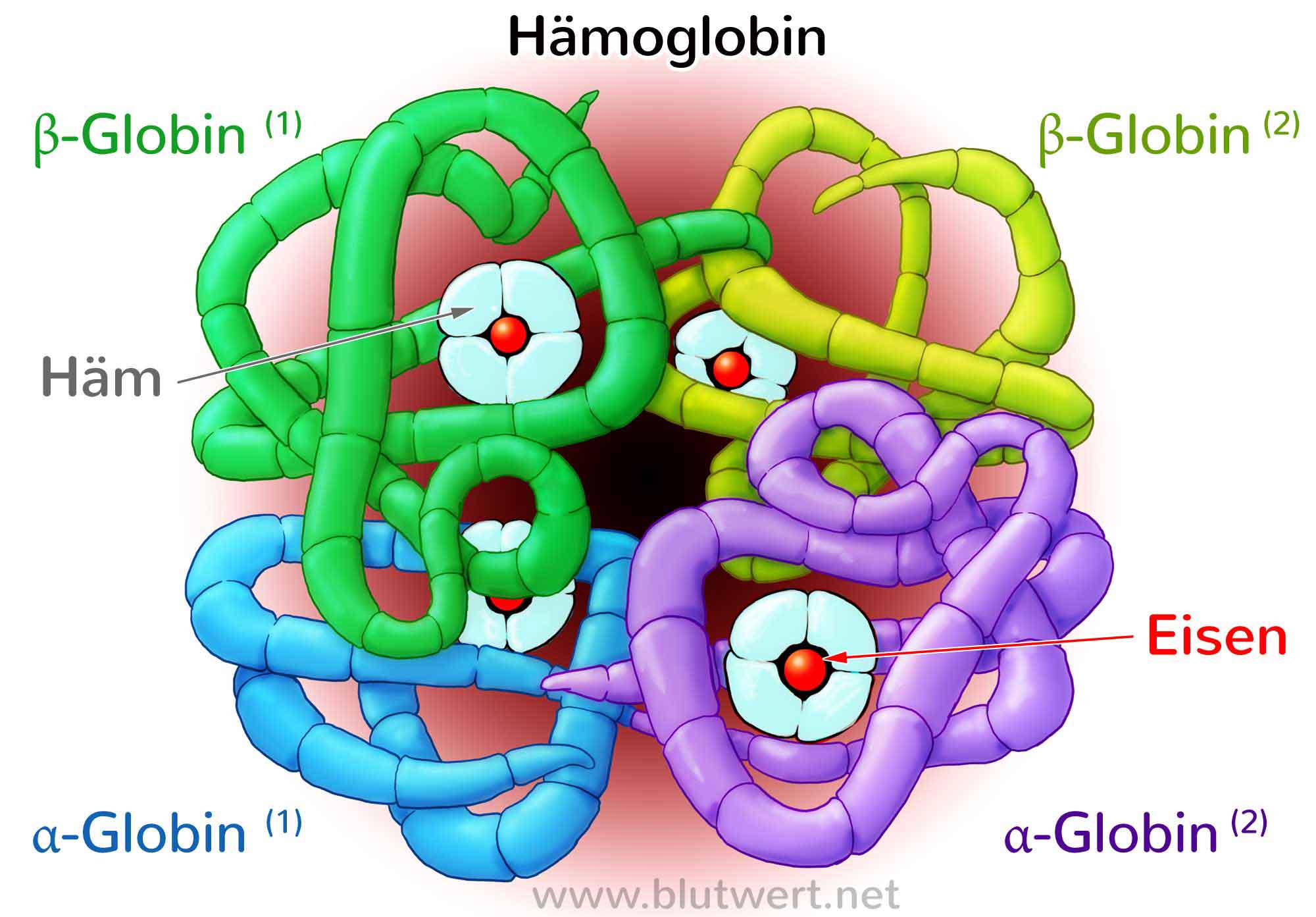
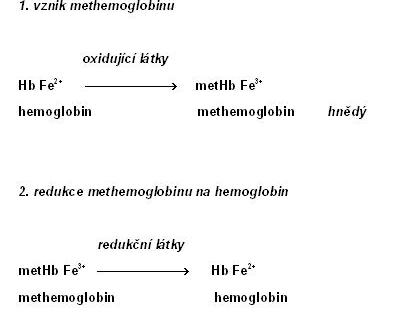
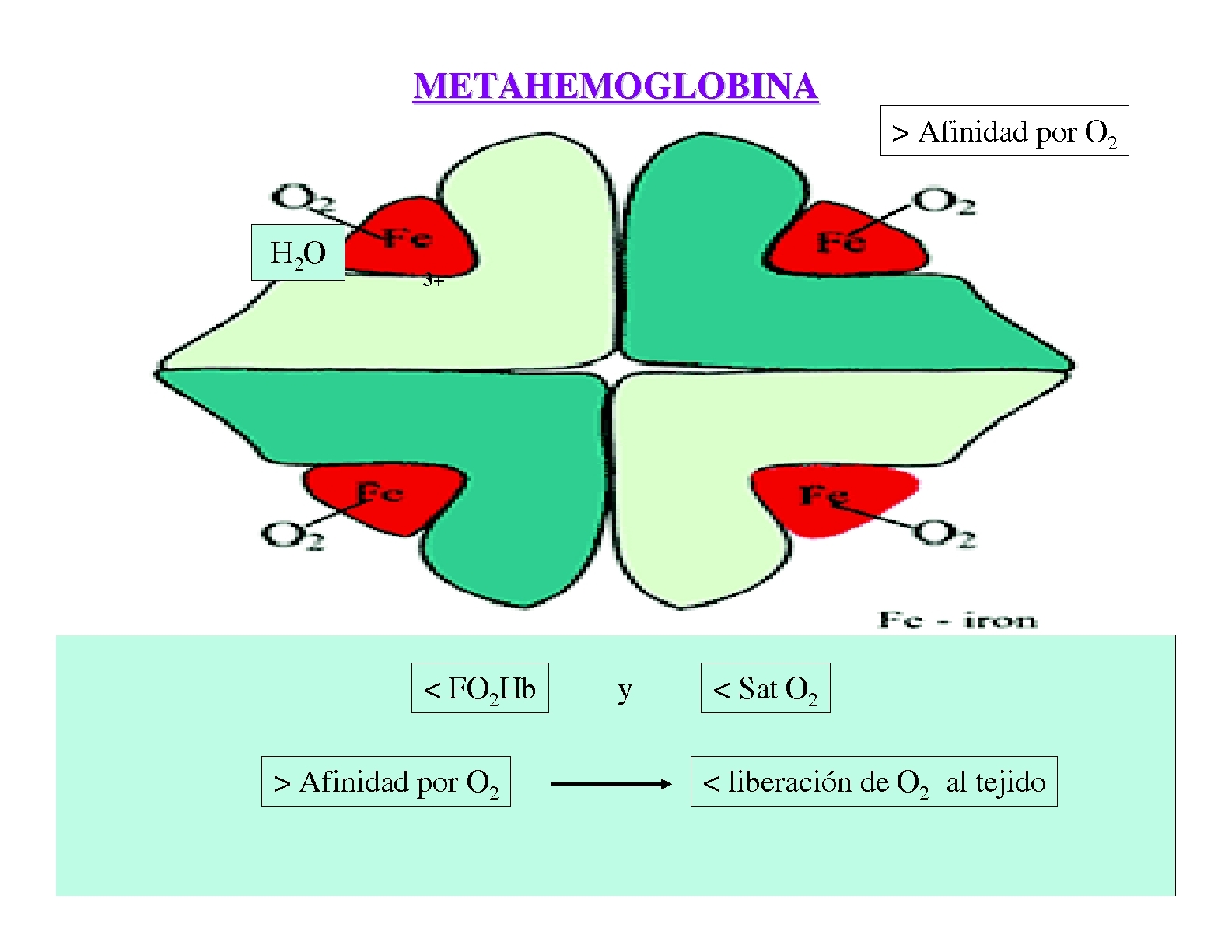
La metahemoglobina es la hemoglobina con grupo hemo con hierro en estado férrico, Fe(III) (es decir, oxidado). Este tipo de hemoglobina tiene mucha afinidad por el oxígeno molecular por lo que no llega a soltar dicha molécula y como consecuencia, no puede unirse a otras moléculas de oxígeno. Cuando la concentración de esta proteína sobrepasa los niveles normales, se produce la metahemoglobinemia caracterizada por cianosis [1].
Tipos y causas
Se han descrito múltiples variables de metahemoglobinas o hemoglobinas M congénitas provocadas por mutaciones puntuales, las cuales no responden a oxigenoterapia. En estas, las mutaciones se pueden producir en las α, β o γ, lo que conduce a la oxidación espontánea del ion Fe (II) en el grupo hemo a su estado Fe (III) que no puede transportar o liberar oxígeno de forma adecuada en los tejidos. Algunas de estas metahemoglobinas se resumen a continuación::[2][3][4]
- Saskatoon, Hyde Park, Boston e Iwate: en esta se han descrito cambios de un aminoácido histidina distal o proximal por una tirosina.
- HbF-M-Fort Ripley se produce por una mutación en la cadena γ (HBG2: c.227 C> T), que conduce a la sustitución del residuo de la histidina en el codón 92 con tirosina. En este caso el hierro se queda estabilizado como Fe(III) y es difícil su reducción a Fe(II).
- Milwaukee-1: presenta una sustitución del aminoácido valina (E11, 67β) por ácido glutámico. Su posición está separada cuatro unidades desde la histidina distal.
Otra causa se relaciona con una deficiencia de la acción de la metahemoglobina reductasa, también conocida como NADH-citocromo b5 reductasa (cb5r). De estas se describen dos variantes: la tipo 1, más frecuente y menos grave, que se circunscribe a la deficiencia de la enzima en los eritrocitos; la tipo 2, la forma más grave y menos frecuente, hay deficiencia de la enzima en todas las células.[2]
Otra enzima conocida como Glucosa-6-fosfato deshidrogenasa (G6PDH), participa indirectamente en la reducción de la metahemoglobina. Generalmente se expresa frente a agentes oxidantes, ya que se reduce la disponibilidad de glutatión reducido, necesario para pasar del hierro Fe(III) a Fe(II).[1]
Por último, resaltar las metahemoglobinas derivadas de intoxicaciones con químicos. En tal caso, se mencionan los alimentos ricos en nitritos/nitratos los cuales son metahemoglobinizantes.[2][5]
Véase también
- popper
- proteína
- sangre
Referencias